Search Thermo Fisher Scientific
质谱分析技术资源

获取技术资源以改善质谱分析结果
在此网页上,您将发现一系列有价值的工具以助您改善质谱分析结果,包括手册、应用特定白皮书和技术资料、最新海报和有用的网络讲座。
手册和宣传册
改善蛋白质组学结果的新工具
本手册重点介绍了2020至2022年发布的产品,包括快速 MS 蛋白样本制备试剂盒、用于定量分析癌症信号通路中蛋白的 MS 靶向多通路检测组合试剂盒、TMTpro™ 18plex 标记试剂——新一代串联质谱标签和新系统适用性标准品来评估 LC-MS/MS 系统的灵敏度和动态范围。
质谱分析核心要素手册
本手册长达40页,重点介绍了质谱分析核心实验室可使用的一些基本工具,以为用户提供可靠且一致的数据。这些试剂盒和试剂经过全面检测,可提供较佳结果(从蛋白消化到肽富集、纯化和定量)。
利用质谱分析手册进行蛋白样本制备和定量
本手册长达168页,提供蛋白样本制备、定量和仪器校准的综述,以便使用质谱分析实现优化的蛋白质组学工作流程。附带指南以选择适合发现型和靶向型蛋白质组学应用的色谱产品、质谱仪和软件。
定制肽合成手册
本手册重点介绍如何优化肽合成的效率。在 Thermo Fisher Scientific,我们拥有丰富的经验、设备和知识,能够满足您对定制肽合成的需求。我们的合成团队通过成功生产成千上万的定制肽积累了丰富的专业知识。我们不断根据您的意见调整我们的产品以满足您的需求。我们经验丰富的肽科学家将为您的检测提供肽序列、规模和/或纯度选择,以帮助您获得应用的最佳结果。
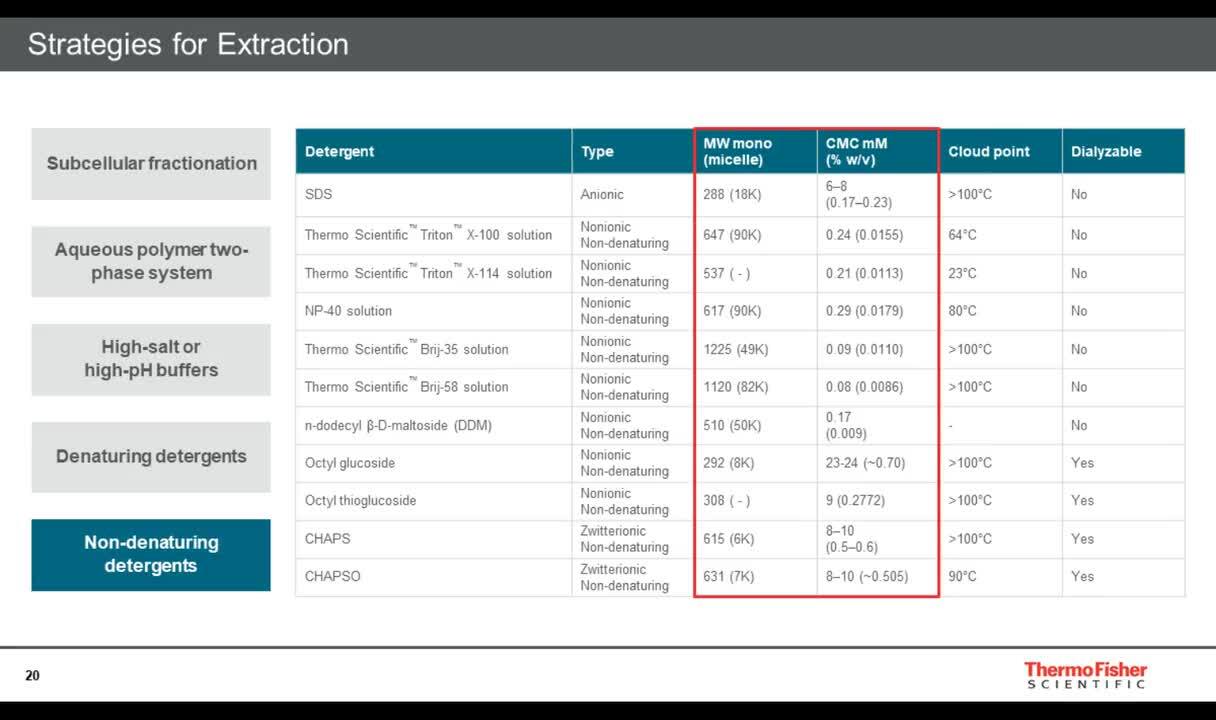
膜蛋白样本制备策略
该网络讲座重点阐述了不同膜蛋白的溶解策略,以及根据下游检测或分析模式需要进行的富集或纯化处理。
细胞膜蛋白的分离策略
讲座着重介绍高效提取、分离和富集细胞表面蛋白的优化方案,包括如何获取稳定的 G 蛋白偶联受体 (GPCR) 并保留蛋白功能性。
TMTpro 质量标记和蛋白质组学样本制备
该网络讲座讨论了样本多通路检测的优势并回顾同量异位标签工作流程。将引入新 TMT 化学法和应用以及 MS 样本制备与定量工作流程的集成。
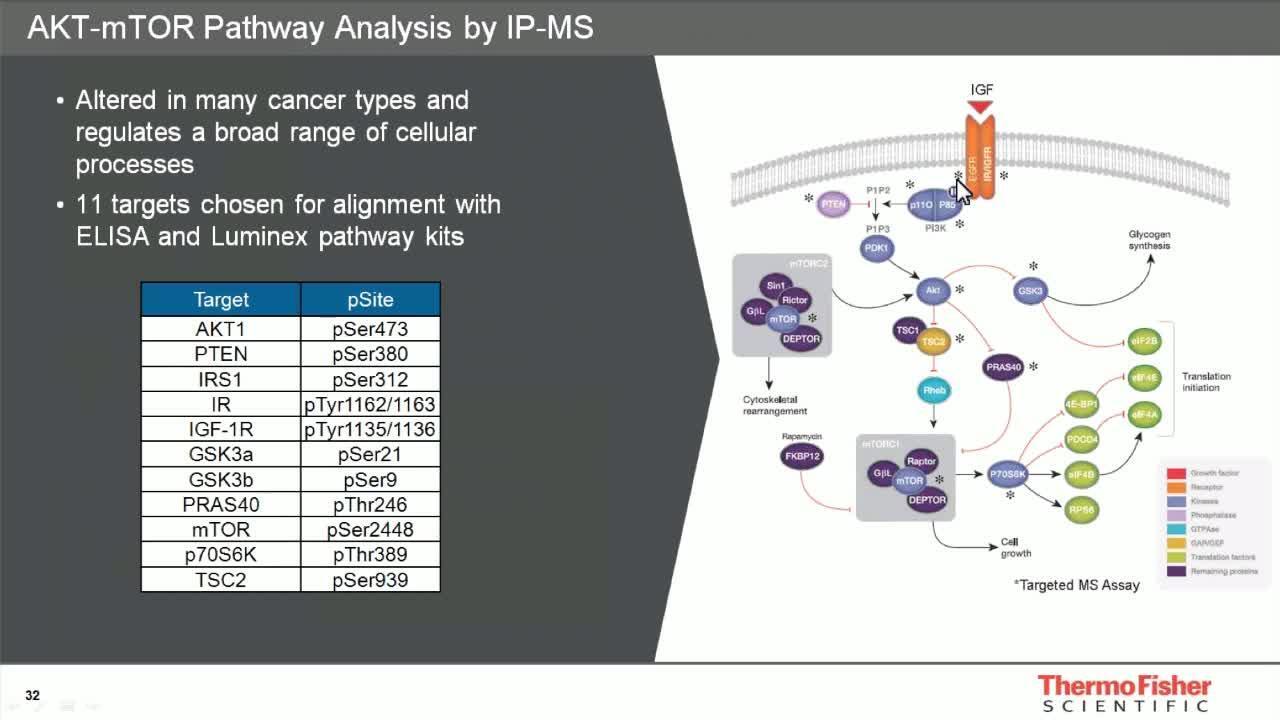
利用靶向质谱分析应用来研究 AKT-mTOR 通路
本网络讲座介绍了基于靶向质谱分析 (MS) 的方法和以改善的样本制备和富集来降低样本复杂性的各种策略,为靶向 MS 测定试剂盒开发提供指导,讲座亦包括使用免疫沉淀 (IP) 和 MS 分析进行抗体验证的讨论。
靶向蛋白质组学定量工作流程
本网络讲座讨论了端到端靶向蛋白质组学的工作流程,包括经严格验证的试剂/方法及其在定量测定感兴趣的蛋白质上的应用。此整体工作流程利用稳定的同位素标记的参考肽的定量能力实现可靠的靶向蛋白定量。
串联工作—第一届年度 TMT 研讨会(2021年)
第 1 天
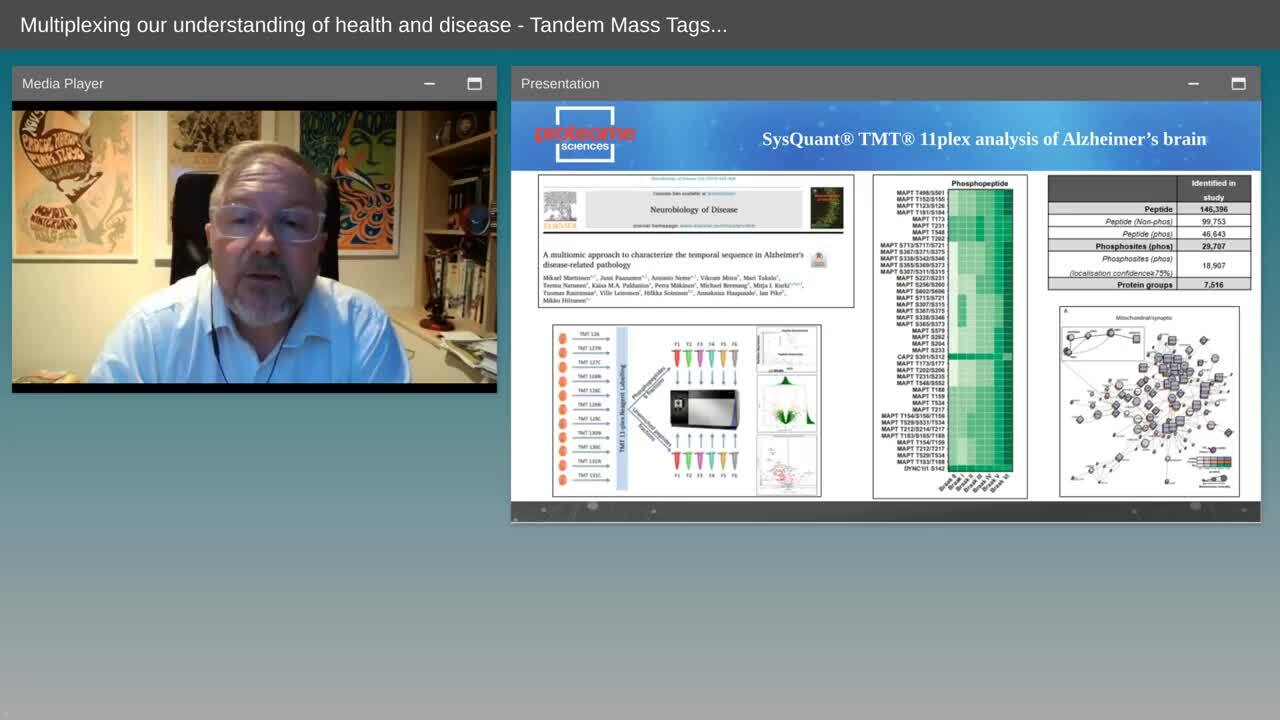
 Multiplexing our understanding of health and disease - Tandem Mass Tags and the coming decade of proteomics
Multiplexing our understanding of health and disease - Tandem Mass Tags and the coming decade of proteomicsThe breadth and depth of proteome quantification is achievable with 18plex TMTpro™. It is driving a better understanding of complex biological questions in basic research, drug development and diagnostic biomarker discovery.
 What is so great about TMT sample multiplexing reagents? Let me count the ways.
What is so great about TMT sample multiplexing reagents? Let me count the ways.Sample multiplexing using isobaric tagging techniques allows for up to 18 samples to be simultaneously compared using the TMTpro18 reagent set.
 Streamlined processing and data acquisition for sample multiplexing
Streamlined processing and data acquisition for sample multiplexingUsing a TMTpro dataset in which the samples were processed with the SL-TMT protocol and the data were collected using FAIMS and RTS on an Orbitrap Eclipse mass spectrometer.
 Automated high-throughput proteomics for large plasma cohort analyses
Automated high-throughput proteomics for large plasma cohort analysesAutomated Multiplexed Proteome Profiling Platform (AutoMP3) for processing hundreds to thousands of samples with help of TMT methods.
 Multiplexed proteomics to measure protein dynamics during cell stress
Multiplexed proteomics to measure protein dynamics during cell stressNovel approaches using TMT to measure protein dynamics by proteomics including the required bioinformatics tools for their analyses.
第 2 天
 Tips and Tricks in Instrument Method for TMT Quantitation Using Latest Version Instrument Control Software
Tips and Tricks in Instrument Method for TMT Quantitation Using Latest Version Instrument Control SoftwareTMT applications in Proteomics is highlited by acquiring high quality TMT quantification data on Thermo Scientific Orbitrap Eclipse Tribrid mass spectrometer, Thermo Scientific Orbitrap Exploris 480 and 240 mass spectrometers
 An overview of identification and quantification of TMT datasets using Proteome Discoverer 2.5
An overview of identification and quantification of TMT datasets using Proteome Discoverer 2.5Proteome Discoverer 2.5 to obtain high quality results for TMT quantification data acquired with Thermo Scientific Orbitrap MS-based instruments.
 Clinical Phosphoproteomics to Uncover New Therapeutic Strategies for Cancer
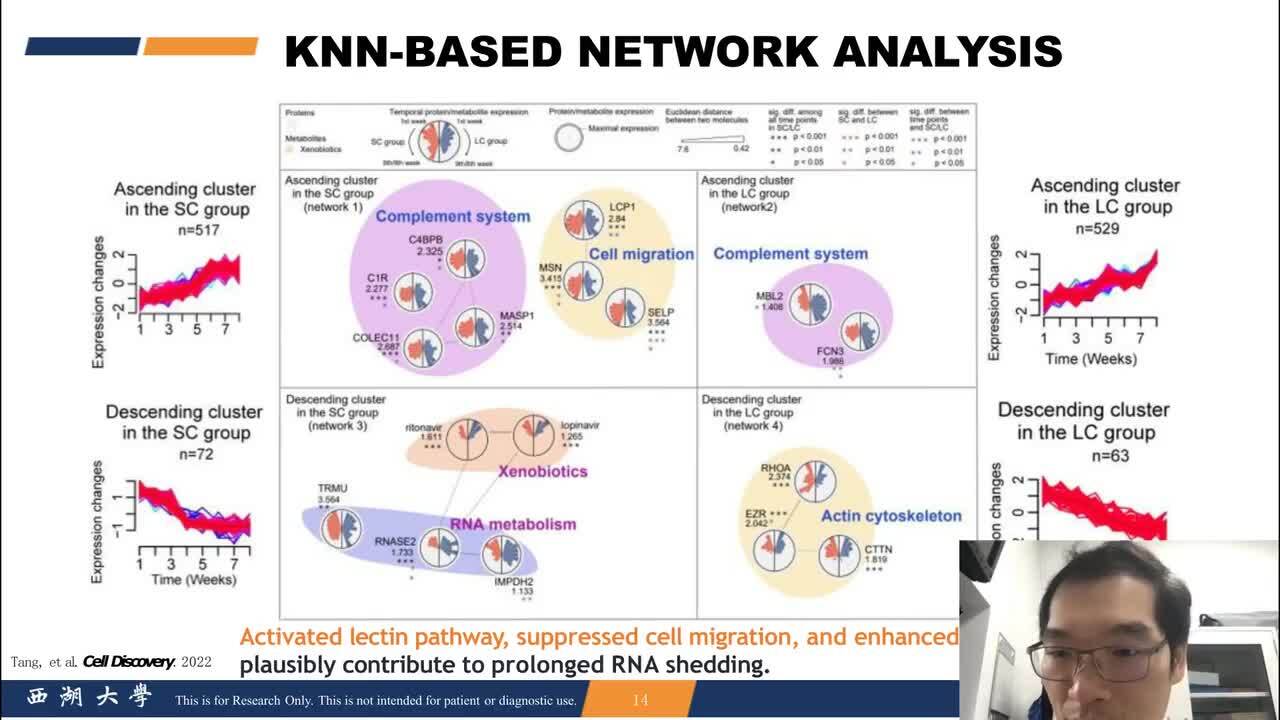
Clinical Phosphoproteomics to Uncover New Therapeutic Strategies for CancerIdentify potential therapeutic targets and therapeutic strategies with multiplexed isobaric tags (TMT) for quantification to gain insight into activated signaling networks
 Network-based Proteomics for Biomarker Discovery in Alzheimer's Disease
Network-based Proteomics for Biomarker Discovery in Alzheimer's DiseaseUsing isobaric tandem mass tag (TMT) based mass spectrometry methods to describe how network-based proteomics has provided an informative framework for the complex protein pathophysiology underlying AD.
 Automated On-antibody TMT Labeling for Ubiquitin Profiling in Multiomics Sample Analyses
Automated On-antibody TMT Labeling for Ubiquitin Profiling in Multiomics Sample AnalysesUbiFast is a highly sensitive method for multiplexed ubiquitylation profiling in which K-ɛ-GG peptides are enriched using antibodies specific to ubiquitin remnants (K-ɛ-GG) followed by on-antibody labeling with TMT reagents.
 Multiplexed proteomics to measure protein dynamics during cell stress
Multiplexed proteomics to measure protein dynamics during cell stressNovel approaches using TMT to measure protein dynamics by proteomics including the required bioinformatics tools for their analyses.
第 3 天
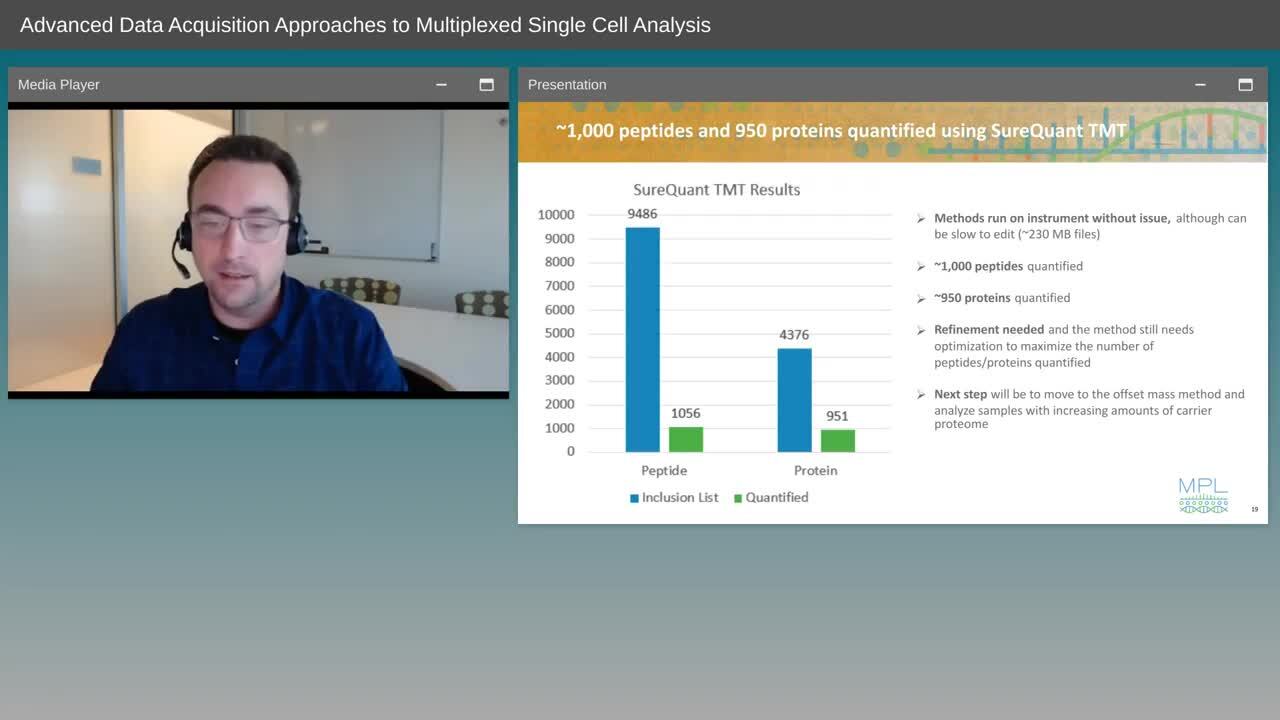
 Advanced Data Acquisition Approaches to Multiplexed Single Cell Analysis
Advanced Data Acquisition Approaches to Multiplexed Single Cell AnalysisSureQuant-TMT enables the monitoring of up to 10,000 peptides derived from a TMT-SH labeled proteome, real-time peptide identification by peak matching, and subsequent selection of endogenous, multiplexed single cell samples only when a carrier prote
 Leveraging TMT multiplexing for increased throughput in protein-centric characterizations of heterogeneity at the single cell level
Leveraging TMT multiplexing for increased throughput in protein-centric characterizations of heterogeneity at the single cell levelA combination of fluorescence-activated cell sorting, automated liquid handling, next-generation chromatography, state-of-the-art MS instrumentation and complex data analysis workflows to provide a comprehensive suite of scMS tools.
 Optimizing TMT-based quantitative cross-linking mass spectrometry strategy for large-scale interactomic studies
Optimizing TMT-based quantitative cross-linking mass spectrometry strategy for large-scale interactomic studiesHCD fragmentation energies and acquisition strategies on TMT-labeled cross-links.
质量多重检测—第二届年度 TMT 研讨会(2022 年)
第 1 天
 Applications of TMTpro-based proteomics for understanding host responses in COVID-19
Applications of TMTpro-based proteomics for understanding host responses in COVID-19Applications of advanced proteomics technologies to interrogate host responses in the sera, urine and tissue specimens from COVID-19 patients.
 Applications of TMT-based Quantitation in Unraveling the Protein Targets of Bioactive Compounds
Applications of TMT-based Quantitation in Unraveling the Protein Targets of Bioactive CompoundsTMT-based thermal proteome profiling (TPP) and provide examples for identifying targets of different classes of compounds.
 Proteogenomic Analysis of Intrahepatic Cholangiocarcinoma
Proteogenomic Analysis of Intrahepatic CholangiocarcinomaGenomic, transcriptomic, proteomic, phosphoproteomic and microbiome studies were performed for the clinical tissue samples from Chinese intrahepatic cholangiocarcinoma (iCCA) patients.
第 2 天
 Enabling a High-throughput Chemo-proteomics Platform for Screening
Enabling a High-throughput Chemo-proteomics Platform for ScreeningWe have optimized TMT reagent usage with our platform to appropriately balance over- and under-labeling, while reducing reagent associated costs and hands on time associated with aliquoting reagents.
 Streamlined TMT protocols to enable low input proteomics of freshly isolated immune cells
Streamlined TMT protocols to enable low input proteomics of freshly isolated immune cellsAn easy to implement, streamlined workflow that enables quantitative proteome profiling from roughly 2 μg of protein input per experimental condition
 SimPLIT: Simplified sample preparation for large-scale isobaric tagging proteomics
SimPLIT: Simplified sample preparation for large-scale isobaric tagging proteomicsA simplified and cost effective one-pot reaction workflow in a 96-well plate format (SimPLIT), based on a sodium deoxycholate lysis buffer, that minimizes processing steps and demonstrates improved reproducibility compared to alternative approaches.
 Modulation of Cysteines upon cellular signalling
Modulation of Cysteines upon cellular signallingIn the present talk we will introduce cysteine modifications, various tools for assessing these and various applications were we have used cysteine-specific proteomics to characterize important cysteine residues in key proteins for cellular signallin
 Thermal Proteome Profiling for Functional and Molecular Characterization of Variant Proteins
Thermal Proteome Profiling for Functional and Molecular Characterization of Variant ProteinsWe propose the use of thermal proteome profiling (TPP) for studying the impact of these disease related sequence variants on a systems wide level. TPP is a bottom up, TMT-based, quantitative mass spectrometry technique for determining the melt curves
第 3 天
 TMT: A Versatile and Powerful Approach for Characterization of Proteomes
TMT: A Versatile and Powerful Approach for Characterization of ProteomesIsobaric labeling TMT experiments with optimal depth and quantitative accuracy for Proteomics.
 An Automated Sample Preparation Solution for Mass Spectrometry-based Proteomics
An Automated Sample Preparation Solution for Mass Spectrometry-based ProteomicsThe automated platform enables hands-off protein lysis, DNA removal, protein reduction and alkylation, digestion, TMT labeling, pooling and cleanup, and peptide concentration measurement, providing several workflows and companion reagents to perform
 Deep learning tools in PD 3.0 (CHIMERYS and INFERYS) for TMT analysis
Deep learning tools in PD 3.0 (CHIMERYS and INFERYS) for TMT analysisDeep learning tools in PD 3.0 (CHIMERYS and INFERYS) for TMT analysis
 Measuring Protein-Turnover with Heavy Isotope Labeling and Complement Reporter Ions
Measuring Protein-Turnover with Heavy Isotope Labeling and Complement Reporter IonsMeasuring Protein-Turnover with Heavy Isotope Labeling and Complement Reporter Ions
 Clinical Phosphoproteomics to Uncover New Therapeutic Strategies
Clinical Phosphoproteomics to Uncover New Therapeutic StrategiesClinical Phosphoproteomics to Uncover New Therapeutic Strategies
串联质量标签研讨会(2022 年)
 TMT Workshop Europe - Session1 - labeling, data acquisition
TMT Workshop Europe - Session1 - labeling, data acquisitionLabeling, data acquisition for tandem mass tag mass spectrometry.
 TMT Workshop Europe - Session2 - data processing in PD-part 1
TMT Workshop Europe - Session2 - data processing in PD-part 1Labeling, data acquisition for tandem mass tag mass spectrometry.
 TMT Workshop Europe - Session2 - data processing in PD-part 2
TMT Workshop Europe - Session2 - data processing in PD-part 2Data processing for tandem mass tag mass spectrometry using Proteome discoverer (PD) software.
 TMT Workshop US - Session1- labeling, data acquisition-part 1
TMT Workshop US - Session1- labeling, data acquisition-part 1Labeling and data acquisition for tandem mass tag mass spectrometry.
 TMT Workshop US - Session1- labeling, data acquisition-part 2
TMT Workshop US - Session1- labeling, data acquisition-part 2Labeling and data acquisition for tandem mass tag mass spectrometry.
要下载任何白皮书和应用文档或整个系列,请单击下面的"立即下载"按钮。
1.使用高 pH 反相肽段预分级来分析复杂混合物中的中到低丰度蛋白
本白皮书介绍了 Thermo Scientific Pierce 高 pH 反相肽段预分级试剂盒如何利用高 pH 反相色谱借助疏水性来分离肽,与低 pH 反相 LC/MS 梯度正交性极佳。该方案简单、高度可重现,有助于进行深度蛋白质组测序。
2.适用于蛋白质组学研究的跨多种分子量范围膜蛋白进行高效、便捷的富集
本白皮书介绍了 Thermo Scientific Mem-PER Plus 膜蛋白提取试剂盒如何能够通过基于试剂的简单程序和台式微量离心机从培养的细胞中富集完整蛋白和膜相关蛋白。该试剂盒利用简单的顺序洗涤剂提取方法分离特定跨多种分子量范围的膜蛋白(≥2个跨膜结构域)以便通过质谱分析实现下游分析。
3.可提高细胞培养物的蛋白质组覆盖率的亚细胞蛋白分级分离方法
本白皮书介绍了 Thermo Scientific 亚细胞蛋白分离试剂盒如何使用低速微量离心以高可重现性在少于传统方法的时间内将细胞逐步裂解为具有功能的细胞质、细胞膜、可溶性核蛋白、染色质结合和细胞骨架蛋白组分,以便通过质谱分析实现优化的下游分析。
4.对人群采样——适用于转化蛋白质组学的超高通量血浆蛋白质分析 (uHTPPP) 的样本制备
本应用文档介绍了质谱大型人群队列研究的强固、精确且可重现的高通量样本制备工作流程。该工作流程使用自动化脚本在 Hamilton 液体处理机器人平台上使用 EasyPep 96 MS 样本制备试剂盒处理血浆或血清以及进行合适的 QA/QC 操作,这些操作可通过将 Thermo Scientific 串联质谱标签标记和肽段预分级整合至工作流程来进一步定制。
5.使用金属氧化物亲和色谱分析的顺序富集 (SMOAC) 以提高定量蛋白质组学分析的磷酸化蛋白质组覆盖率
本应用文档介绍了如何实现深度磷酸化蛋白质组测序。新开发的 SMOAC 方法依次使用 Thermo Scientific High-Select TiO2 和 Fe-NTA 磷酸肽富集试剂盒来富集磷酸肽,接着以 Pierce 高 pH 反相预分级试剂盒分离磷酸肽,这降低了样本的总体复杂性并使未标记多肽和 TMT 标记的多肽的蛋白组质覆盖率更高。本应用文档中介绍的方法是进行大规模的磷酸化蛋白质组学分析的一强大工具。
6.使用 EasyPep 技术进行快速、高效的样本制备:适用基于 MS 的蛋白质组学应用的优化样本制备
此应用文档重点介绍了 EasyPep 样本制备技术,该技术可针对基于质谱分析的蛋白质组学的不同样本、不同规模和通量进行快速和高效的处理。通过采用标准化的工作流程,可使用不同样本类型(包括细胞(哺乳动物、酵母和大肠杆菌)、组织(新鲜和 FFPE)和血浆)以及在下游应用(包括 TMT 试剂标记、高 pH 反相预分级和磷酸肽富集)中实现相同的肽和蛋白鉴别率、质量和重现性。
1.用于改善样本多通路分析的下一代 TMTpro 试剂
本应用文档讨论了使用 TMTpro 试剂改善样本多通路测定的独特优势、标记结构对色谱分析的影响、在配备 FAIMS Pro 的新一代 Orbitrap Eclipse Tribrid 质谱仪上使用 TMTpro 试剂、在 Proteome Discoverer 软件界面上优化仪器设置和数据分析,以在蛋白定量上以较高的准确度和精度实现对样本的深度蛋白质组学分析。
适用于质谱蛋白质组学研究的自动化样本制备解决方案
该海报介绍了一种自动化样品制备解决方案,可简化和标准化质谱 (MS) 样品制备。自动化样品制备平台是一个直观的全套系统(仪器、软件、试剂),可实现标准化的免手动操作,并为无标记蛋白组学和 TMT 应用提供稳健的工作流程。
人血浆样本高丰度蛋白去除——可重现性和扩展研究
该海报介绍了两种新去除树脂的去除能力(效率、去除后蛋白得率和可重现性方面),同时证明人血浆样本中靶标高丰度蛋白 >95% 的去除效率。
采用提升特异性的富集方法富集的细胞表面蛋白的蛋白质组学分析
本海报介绍了使用与质谱分析兼容并采用背景减少的胺基化学法而开发的稳健细胞表面蛋白分离方法。
EasyPep——用于 MS 样本制备的新型简化和优化的工作流程
本海报介绍了一种简化的样本制备试剂盒,其中包含预配制试剂和标准化方案,可用于在4小时内有效处理10µg 至100µg 蛋白样本。
针对96孔自动化液体处理系统调整 EasyPep 样本制备
本海报介绍了支持较高的样本处理通量、适于与自动化液体处理系统一起使用以进行样本制备、TMT 标记和多肽纯化的新96孔过滤板规格的开发。该标准化工作流程可兼容几种样本类型(细胞系、组织、纯化蛋白、血浆和血清)且具有高重现性和低缺失切割。
用于质谱分析应用的福尔马林固定石蜡包埋组织的经优化样本制备方法
本海报介绍了与 EasyPep MS 样本制备方法和随后的 LC-MS/MS 分析兼容的从 FFPE 组织中提取蛋白的优化方案开发。
适用于快速和高效的质谱蛋白质组学研究的 EasyPep 样本制备技术
这张海报介绍了两种采用 Thermo Scientific EasyPep 技术的样品制备试剂盒——大规模 (Maxi) 样品制备试剂盒和 96 孔板形式试剂盒。本研究使用细胞、组织和血浆样本,重点阐述了每种规格对于不同样本类型和各种应用的独特功能。
适用于磷酸肽富集工作流程的大规模 EasyPep MS 样本制备
该海报介绍了新大型柱规格的开发,该规格易于使用我们的 EasyPep 样本制备化学试剂进行调整和扩展以便达到较高蛋白含量 (>1mg),从而使用固定化金属亲和色谱 (IMAC) 进行后续磷酸肽富集。
用于磷酸化蛋白质组学工作流程的高效 pH 反相样本组分分离
该海报演示了在基于 MS 的磷酸化蛋白质组学工作流程中对磷酸肽进行高 pH 反相组分分离的实用性和优势。
SMOAC(从 MOAC 顺序富集,读音同“Smoke”)是一种从磷酸化单肽中多次磷酸化分离的磷酸化蛋白质组学策略
此海报介绍了先使用 TiO2 再使用 TiO2 流出物 (FT) 富集磷酸肽的 SMOAC(使用金属氧化物亲和色谱分析顺序富集)方法,并演示了深度磷酸化蛋白组分析的工作流程。
使用 Fe-NTA 磁珠和 KingFisher Apex 磁性颗粒处理仪自动进行磷酸化富集
该海报介绍了一种基于琼脂糖的 Fe-NTA 磁珠,该磁珠用于使用 Thermo Scientific Kingfisher Apex 磁性颗粒处理仪的手动和自动磷酸肽富集工作流程,以进行高通量应用。
质谱分析应用适用的以蛋氨酸亚砜还原酶逆转录氧化的蛋氨酸
该海报介绍了重组蛋氨酸亚砜还原酶 (MetSR) 的两种活性形式的合成以及完整蛋白、靶向定量肽以及鸟枪法蛋白质组学的质谱分析应用的原理论证研究。
血浆蛋白质组学分析——用于相对定量的样本制备和多通路工作流程
本海报介绍了使用 Pierce Top14 高丰度蛋白去除离心柱去除血浆中高丰度蛋白的可重复程序的开发,该程序可用于检测样本中更多的蛋白,从而更好地检测和定量相关生物标记物。
使用 NeuCode SILAC 信号蛋白标记进行多通路定量分析
本海报展示了多通路免疫沉淀与使用细胞培养物中氨基酸 (SILAC) 进行稳定同位素标记的多通路定量联用的效用,使用了 AKT/mTOR 通路靶标的鉴别和相对定量分析的中子编码氨基酸 (NeuCode™)。
LC & MS 应用开发 & 系统适用性测试适用的全重组完整蛋白标准品的开发
该海报介绍了 HPLC、MS、LC-MS/MS 质量控制、方法开发以及针对自上而下蛋白质组学应用(包含宽分子量范围、m/z 范围和良好的色谱分离)的优化的高质量完整重组蛋白标准混合物的开发。
串联质谱标签 (TMT) 工作流程适用的质量控制标准品的开发
该海报介绍了采用串联质谱标签™ (TMT™) 试剂的多通路蛋白质组学定量策略的 TMT11plex 酵母菌消化标准品的开发。此标准品有助于为色谱分析、质谱分析 (MS) 和数据分析进行 MS 方法优化。
使用 TMT 11plex 试剂和综合性磷酸肽富集策略定量分析信号通路
该海报展示了 TMT11plex 配合“SMOAC”方法在不同条件下全面鉴别和定量磷酸肽。此改进的工作流程可实现对磷酸肽的出色选择性和特异性。
评估蛋白测量准确度和精度的 TMTpro 18plex 蛋白质组学标准品
该海报介绍了以 TMTpro 标记的酵母菌消化标准品来测量使用不同 LC-MS 方法和仪器的蛋白定量的准确度和精度。基于同步母离子选择 (SPS) 方法的准确度和精度远高于 MS2 方法。此外,使用 FAIMS Pro 接口还提高了 MS2 和 MS3 方法的蛋白测量准确度。
优化 TMTpro 标记的蛋白质组学样本的样本制备和离线高 pH 反相组分分离
该海报介绍了制备复杂蛋白质组学样本的可靠工作流程的开发,此工作流程包括使用串联质谱标签试剂进行标记、高效纯化和离线高 pH 反相以进行全面对比分析。
用于癌症信号蛋白定量分析的质谱分析靶向测定的应用
该海报介绍了新型 Thermo Scientific SureQuant 通路检测组合,其利用经优化的多通路免疫沉淀到靶向质谱分析 (mIP-tMS) 工作流程以便对 AKT/mTOR 通路蛋白进行高精度监测。
使用优化的磷酸肽富集方法并结合内部标准品触发的靶向 MS 测定进行定量、全面的多通路信号分析
该海报介绍了将 SMOAC(使用金属氧化物亲和色谱进行顺序富集)、146 AQUA™ 重质标记磷酸肽标准品以及内部标准品触发的靶向 MS 相结合以评估不同刺激条件下磷酸化蛋白丰度变化的工作流程。
用于信号通路蛋白绝对定量的靶向质谱分析测定试剂盒
该海报介绍了经优化的多通路免疫沉淀 (IP) 到靶向质谱分析 (MS) 工作流程的开发,该工作流程用于同时富集和绝对定量 AKT 通路上多种蛋白的总丰度和磷酸化水平以及 RAS 和 TP53 水平。
用于定量分析多个信号通路的磷酸化蛋白的 SureQuant 靶向质谱分析标准品和测定试剂盒
该海报介绍了信号通路中磷酸化的研究,以了解正常的细胞生长和导致不受管制生长(导致癌症)的中断。磷酸肽适用性标准品是评估 LC-MS 系统性能的较佳工具。 重标记多通路磷酸肽标准品的加入可检测出131种不同的磷酸化事件。
在 Orbitrap Fusion Lumos 质谱仪上优化交联肽分析
该海报介绍了通过化学交联肽的分析来改善蛋白内和蛋白间相互作用的鉴别的新试剂。
适用监管环境中蛋白分析的 LC-MS/MS 系统适用性评估与自动数据处理
该海报介绍了 LC-MS 系统适用性分析的质量控制标准品的创建以及使用 Chromeleon CDS 软件进行的此 LC-MS 系统适用性标准品的自动化数据分析,该软件实现了 GxP 和 21 CFR Part 11 的合规性
在以下问题解答中我们汇总了最常收到的关于样本制备、蛋白定量、标准品和校准品等问题的信息。
问:相对和绝对定量之间有何区别?哪类定量用于蛋白质组学样本?
答:相对定量用于比较不同样本中分析物的数量。绝对定量使用不同浓度的已知标准品测量样本中分析物的实际数量。无标记、SILAC 和 TMT 工作流程用于蛋白样本的相对定量。重(即 AQUA)肽用于绝对定量靶蛋白的标准品。
问:串联质谱标签 (TMT) 试剂的主要用途是什么?
答:串联质谱标签技术用于单独标记不同的蛋白样本,以便它们可合并成一个样品以进行 LC-MS 分析。该工作流程的主要优点是样本处理量较高、仪器分析时间较短、重复检测中肽定量精度高以及不同样本中定量蛋白缺失较少。
问:TMT 试剂能否与 TMTpro 试剂组合使用?
答:TMT 和 TMTpro 试剂是质量不同的相异化学品。因此,我们不建议混合两种标记,因为组合样本明显更复杂,会导致定量蛋白减少。
问:我可以使用什么类型的质谱仪进行串联质谱标签 (TMT) 分析?
答:我们建议使用高分辨率 Orbitrap Tribrid(例如 Fusion、Lumos、Eclipse)、Orbitrap Exploris(例如 240、480)或 Q Exactive(例如 Plus、HF 和 HFX)系列仪器。
问:不同的定量系统可配合使用哪些样本类型?
答:无标记、TMT 试剂和 TMTpro 试剂可与任何蛋白样本类型配合使用。SILAC 和 Neucode 只能用于可进行代谢标记的细胞系&模式生物。
问:可以将多少个样本组合以用于同时、多通路蛋白质组学分析?
答:SILAC 可用于多通路检测2至3个样本。TMT 试剂可用于组合6至11个样本。TMTpro 试剂可用于同时测量多达16个样本。
问:在标记多肽后,是否有必要去除游离的 TMT 标签?如果有必要,推荐使用哪种方法?
答:多肽样本内多余的未反应或淬灭 TMT 标签会干扰基于比色法的多肽测定、LC-MS 色谱分析并影响 LC-MS 过程中的多肽/蛋白鉴别。内嵌式 LC 捕获柱可用于去除一些多余的试剂。EasyPep 试剂盒中的多肽纯化柱也可用于去除多余的 TMT 标签。Pierce 多肽脱盐离心柱(货号89852)可用于纯化以替代样本制备方法标记的样本。
问:在 EasyPep 样本制备工作流程中,描叙了在纯化步骤前或后将 TMT 添加至多肽中。这两种方法在标记效率或相对定量方面是否有任何区别?
答:EasyPep 试剂盒化学成分与 TMT 试剂完全兼容。通常,TMT 试剂在消化后和多肽纯化前立即用于标记多肽。这样,可组合样本以进行一个纯化步骤,从而可降低重现性较高的定量测量的可变性。另一方法是在多肽纯化后标记样本。该方法可有效标记样本,但可能需要使用多肽定量测定试剂盒,以确保样本在 LC-MS 分析前均匀混合。使用我们推荐的 TMT 与样本比,这两种工作流程均可提供高的标记效率。
问:我如何连接不同样本集的数据以进行 TMT 定量?
答:这通常利用每个多通路集的"池通道"完成。该参考通道通常包含所有样本的等摩尔混合物,该混合物使用各集共用的 TMT 标签之一标记。然后,池通道可用于对跨多通路集的相对蛋白丰度测量进行归一化。
问:我是否需要应用校正因子来分析 TMT 标记样本的数据?
答:由于同位素杂质在不同的标签中是不同的,范围从5-10%不等,因此需要使用校正因子来进行更准确的相对蛋白定量。
问:与未标记样本相比,我的组合 TMT 标记样本中的多肽/蛋白鉴别数量较少——我该怎么办?
答:我们建议在 LC-MS 分析前使用 Pierce 高 pH 反相肽段预分级试剂盒 (货号84868)对样本组分分离以降低样本的复杂性,这样会增加多通路样本的可定量多肽/蛋白的数量。
问:我的样本的 TMT 标记水平较低 (<95%)。我应检查什么?
答:可使用 TMT/TMTpro 作为可变(即动态)修饰肽氨基末端和赖氨酸来搜索多肽以确定各标记样本的标记效率。多肽与标记的质量比 (w:w) 应为 1:4 至 1:8,以便完整标记大多数样本。如果处理或储存不当,TMT/TMTpro 试剂也会出现水解,使其反应性降低。
问:我的 SILAC 蛋白中的重氨基酸掺入率很低。我应检查什么?
答:检验无轻赖氨酸(和/或精氨酸)与透析胎牛血清的 SILAC 培养基是否用于细胞培养。另外,检验在 SILAC 培养基中培养的细胞是否健康、存活且活跃生长。
问:我可以使用什么 MS 软件进行蛋白&多肽定量?
答:Proteome Discoverer、MaxQuant、Skyline(靶向分析适用)可用于蛋白&多肽定量。
问:我的多肽鉴别数量很不错,但重复样本间的差异性很高。您建议如何提高样本的可重现性?
答:检查您的样本制备工作流程以确保蛋白提取、还原/烷基化、消化和纯化的一致性。我们建议使用 EasyPep 产品(货号A40006)进行高质量、可重现的样本制备。 我们还建议使用 Pierce 定量荧光肽检测试剂盒(货号23290)或 Pierce 定量比色肽检测试剂盒(货号23290)定量多肽,以确保在每个 LC-MS 分析中分析相同的多肽数量。可重现性差也可能与 LC-MS 系统性能有关,这可能需要使用 Pierce 校准溶液重新校准。也可使用蛋白消化标准品(如 Pierce HeLa 蛋白消化标准品(货号88328)或 Pierce TMT11plex 酵母菌消化标准品(货号 A40938))和多肽标准品(如 Pierce 肽保留时间校准混合物(货号88321)或 Pierce LC-MS/MS 系统适用性标准品(7 x 5 混合物)(货号 A40010))来评估系统性能。
问:Thermo Scientific 校准溶液是否适用于其他供应商的 MS 仪器?
答:Thermo Scientific 校准溶液专门设计用于 Thermo Scientific MS 仪器。请向您的 MS 仪器供应商咨询其可推荐的质量校准溶液。
问:哪种校准溶液最适合每台 Thermo Scientific 仪器?
答:推荐针对不同 Thermo Scientific MS 仪器和应用使用不同的校准溶液。您可在此处找到每种校准溶液及其推荐用途的图表和说明。
问:MS 校准溶液在室温下是否稳定或应储存在其他容器中?
答:MS 校准溶液应依 MS 校准数据表或标签上的储存温度来储存,以达最长的有效期。校准溶液必须保存在原容器中,以保持溶液稳定性和纯度。不建议使用过期校准溶液校准 MS 仪器。
问:建议使用哪种标准品确定 LC-MS 系统适用性?
答:建议使用 Pierce 肽保留时间校准混合物(货号88321)优化 LC 系统和梯度。Pierce BSA 消化物,等摩尔,LC-MS 级(货号88342)、Pierce 6 蛋白消化物,等摩尔,LC-MS 级(货号88342)和 Pierce HeLa 蛋白消化标准品(货号88328)可用于"自下而上"的 LC-MS 方法优化和确定 LC-MS 适用性。Pierce LC-MS/MS 系统适用性标准品(7 x 5 混合物)非常适合评估 LC-MS 系统在发现和靶向多肽定量工作流程中的梯度、灵敏度和动态范围。Pierce TMT11plex 酵母消耗标准品(货号 A40938)应用于评估 TMT 定量工作流程的系统性能。建议以 Pierce 6 蛋白完整混合物(货号 A33527)优化"自上而下"的 LC-MS 方法以及确定 LC-MS 适用性。
问:我如何评估自己的 LC-MS 系统性能?
答:评估整个 LCMS 系统性能的最佳方法是使用校准溶液 (MS)、多肽保留时间标准品(Pierce 保留时间校准混合物 (PRTC) 和 Pierce LC-MS/MS 系统适用性标准品(7x5 混合物)以及您应用专用的已知标准样本(例如 HeLa 消化物、BSA 消化物、6种蛋白消化物)。建议经常定期地评估 LC-MS 系统性能,以比较不同时期的结果。
问:Pierce 保留时间校准混合物 (PRTC) 和 Pierce LC-MS/MS 系统适用性标准品(7x5 混合物)有什么区别?
答:PRTC 是疏水性不同的15种多肽的混合物,可用于测定纳流和毛细管流 LC 色谱分析的质量和柱性能。7x5 标准品含有15个 PRTC 多肽中的7个,这七种多肽中的每一种均有五种同位素体形式,包含无重、1 重、2 重、3 重和 4 重同位素标记的氨基酸。以不同浓度提供各多肽的同位素体,以生成7条标准曲线从而评估系统性能。除了评估 LC 色谱分析,该标准品还用于评估 LC-MS 系统的动态范围和灵敏度。
问:在针对蛋白质组学应用安装新柱后,如何验证 LC-MS 系统?
答:应通过技术重复进样合适标准样本(例如 Pierce HeLa 蛋白消化标准品、Pierce BSA 消化标准品或 Pierce 6 混合蛋白消化标准品)几次以使新柱平衡并将新柱与参考色谱图进行比较。
问:如何分析 Pierce 保留时间校准混合物 (PRTC) 和 Pierce LC-MS/MS 系统适用性标准品(7x5 混合物)标准的数据?
答:创建一个新的 Skyline 文档,其中包含15个 PRTC 重同位素标记的多肽。Skyline 文档可用于使用 MS1 过滤器进行 DDA 数据分析或者使用靶向 MS 过滤器进行 PRM/SRM 数据分析。7x5 标准品的 Skyline 文档可以网络下载文档的方式取得。有关详细信息,请参阅 7x5 标准品标签。或者,可使用预置的报告模板(网络下载文档)在 Chromeleon 软件中分析 7x5 标准品数据。
问:Pierce 利血平标准品有何用途?
答:适用于 LCMS 的 Thermo Scientific Pierce 利血平标准品是确定所有 Thermo Scientific MS 仪器性能和灵敏度的标准品。在使用前,必须按照相应仪器入门指南中规定的程序稀释此标准品。
问:使用您的校准溶液时,您建议该使用哪种注射器?
答:我们建议使用 500 µl Hamilton 注射器(产品编号81265)直接输注校准溶液。在两次使用之间,注射器和管路可使用 LC-MS 级的 50% 甲醇/50% 水进行清洁,并应干燥保存。避免将注射器或管子与校准溶液存放在一起。
问:如何使用 Pierce TMT11plex 酵母菌消化标准品来优化我的 LC-MS 采集参数?
达:Pierce TMT11plex 酵母菌消化标准品(即 TKO 标准品)可用于快速、准确地评估 TMT 定量质谱蛋白质组分析的离子干扰(类似质荷比的多种分析物的共分离)。
问:我使用蛋白消化样本进行的蛋白质鉴定次数较少——我该怎么办?
答:使用我们的 Pierce HeLa 蛋白消化标准品(货号88328)检查您的 MS 系统性能。分析此标准品可以帮助确定问题出在样本制备还是 LC-MS 系统。
问:我在 LC 色谱图中观察到肽保留时间变化——是否具有能检查我的 LC 性能的标准品?
答:可以的,Pierce 肽保留时间校准混合物(货号88321)或 Pierce LC-MS/MS 系统适用性标准品(7x5 混合物)提供合成重肽,以便诊断并排除 LC 系统组件/属性(泵、流量计、捕获柱、分离柱和梯度)的故障。
问:对我的多肽样本进行的数据库搜索显示鉴定次数少且/或没有鉴定,但我的色谱仪信号极佳。可能有什么问题?
答:您的仪器可能需要校准。使用我们任一的 Pierce 校准溶液重新校准。验证数据库搜索是否使用了正确的搜索参数(例如,物种、酶、碎片离子、质量容差等)
问:是否有方法评估我的三重四极杆 MS 仪器的灵敏度?
答:可以的,Pierce 利血平 LC-MS 标准品(货号88326)可用于评估仪器的灵敏度。
问:在运行 Pierce TMT11plex 酵母菌消化标准品(货号 A40938)后,我观察到 TMT 报告离子的信噪比低且定量准确性差。您推荐进行什么操作?
答:使用我们任一的的 Pierce 校准溶液清洁和重新校准 MS 仪器。验证 LC 采集方法的设置。
问:我的校准光谱中存在多余的色谱峰。校准溶液是否受到污染?
答:MS 校准过程中出现多余的色谱峰可能是由于离子传输管、离子源、注射器、峰形管或校准溶液受到污染。离子传输管和注射器可以在 50% LC-MS 级甲醇/水中以超声处理清洁。所有校准溶液均经过纯度测试;然而,污染的注射器或在另一容器中分类筛选校准溶液均可能引入污染。
问:使用 Pierce 保留时间校准混合物 (PRTC) 或 Pierce LC-MS/MS 系统适用性标准品(7x5 混合物)进行 LC-MS 分析后,色谱分析随时间出现变化。如何修复色谱分析,从而提高其重现性?
答:吹扫 LC 系统并检查流量计校准。检查流动相溶剂和 LC 梯度。评估并根据需要更换柱。重新运行 PRTC/7x5 混合物以验证重复运行中的色谱分析是否一致。
问:如果重标记的肽不与内源性肽共洗脱,我应该怎么办?
答:验证重肽和内源性肽的相对碎片离子强度是否是相似的。如果相对碎片离子谱没有问题,重肽序列或纯度可能存在问题。重新订购重肽或为感兴趣的靶标选择新的独特肽。
问:哪类物质干扰质谱分析?
答:几乎所有物质!盐、缓冲液、洗涤剂和其他小分子都可能干扰液相色谱分离和质谱仪源电离。
问:去除小污染物的最佳方法是什么?
答:对于蛋白样本,Pierce 聚丙烯酰胺脱盐离心柱 (货号89849)可用于去除盐和其他小分子量污染物。如果您拥有至少10 µg 的样本,建议使用丙酮沉淀来处理低蛋白量。对于从蛋白消化物得到的多肽肽样本,使用 Pierce 肽脱盐离心柱(货号89852)或 Pierce C18 离心吸头(货号84850)进行样本纯化。
问:脱盐柱可否用于多肽肽样本的蛋白纯化?
答:否。蛋白脱盐柱(例如 Zeba 脱盐柱)使用体积排阻,其截留分子量对多肽肽样本通常过高。多肽脱盐使用反相色谱分析树脂(例如 C18)结合多肽,以便在洗涤过程中脱盐。
问:去除洗涤剂的最佳方法是什么?
答:使用丙酮沉淀、透析或 Pierce 洗涤剂去除树脂可以轻松去除蛋白级洗涤剂。
问:哪类缓冲液和溶液与多肽纯化和 LC-MS 兼容?
答:大多数有机溶剂或挥发性缓冲液与 LC-MS 兼容。含 0.1% 甲酸的水或乙腈溶液是用于分离 MS 多肽样本的最常用溶剂系统。三氟乙酸 (TFA) 是离线肽 C18 清理或 LC-UV 分析的替代离子配对剂。可用的 LC-MS 级试剂有 0.1% TFA(货号85172)、LC-MS 水(货号85189)、乙腈 (货号85188)和 TFA(货号:85183)。
问:如果我已经去除蛋白级的小污染物和洗涤剂,在消化后,我是否仍然需要纯化多肽?
答:是的!建议在蛋白消化后持续进行额外的清理,以去除残留的盐或部分消化的蛋白。使用 Pierce 肽脱盐离心柱 (货号89852)、 Pierce C18 离心吸头(货号84850)或内嵌式 C18 捕获柱(货号160434)。
问:我如何确定样本是否兼容并且可以直接用于 LC-MS?
答:用 LC/MS 级试剂制备的样本适用于 LC-MS;但是,颗粒和其他小分子都可能干扰液相色谱分离和质谱仪源电离。目测检查样本是否有颗粒物。使用 Pierce 肽脱盐离心柱(货号89852)、Pierce C18 离心吸头(货号84850)或内嵌式 C18 捕获柱(货号160434)在 MS 分析前去除非挥发性盐。
问:去除样本中多余的 TMT 试剂的最有效方法是什么?
答:我们的 EasyPep 样本制备试剂盒(货号 A40006)专为此用途进行了优化,可去除使用此试剂盒制备的蛋白消化物中多余的 TMT 试剂。为了去除使用其他样本制备方法制备的样本中多余的 TMT 试剂,我们推荐使用 Pierce 肽脱盐离心柱(货号89852)或 Pierce 高 pH 反相组分分离试剂盒。
问:我使用 C18 对样本脱盐,但大多数的多肽也不见了。发生了什么事?
答:多肽在中性pH值或在有机溶剂(如乙腈)存在的情况下无法与反相树脂很好地结合。确保在纯化前和纯化后不存在有机溶剂(在 SpeedVac 或等价物上干燥样本),然后在脱盐前使用甲酸或三氟乙酸 (TFA) 将蛋白消化样本酸化至 pH <3。
问:我应该使用哪种多肽测定试剂盒定量我的样本:Pierce 定量比色肽测定试剂盒(货号23275)还是 Pierce 定量荧光肽测定试剂盒(货号23290)?
答:多肽测定试剂盒的选择取决于样本类型和样本缓冲液的成分。荧光肽测定试剂盒不能用于测量含化学修饰胺的肽,如乙酰化肽或 TMT 标记蛋白消化物。比色测定试剂盒可测量较广泛的样本,但没有荧光测定试剂盒灵敏,需要较多样本才能准确检测。最后,两种测定试剂盒都容易干扰样本或缓冲液中的化合物,应避免或去除这些化合物以获得最佳结果。
问:EasyPep MS 样本制备试剂盒是否与 IP-MS 样本兼容?
答:EasyPep MS 样本制备试剂盒可用于在免疫沉淀后处理样本。但 EasyPep 裂解缓冲液不应用于免疫沉淀,因为其含有干扰抗原结合的变性洗涤剂。
问:我是否可以使用蛋白酶抑制剂进行 MS 样本制备?
答:我们不建议添加蛋白酶抑制剂,因为它们会影响胰蛋白酶和胰蛋白酶/Lys-C 活性。如果蛋白样本或细胞中存在蛋白酶抑制剂,则应在酶消化前通过透析、透滤、脱盐或蛋白沉淀去除。在进行磷酸肽富集工作流程的细胞裂解前,建议向裂解溶液中添加磷酸酶抑制剂。
问:哪些样品类型已经用 EasyPep MS 样本制备试剂盒进行了测试?
答:EasyPep MS 样本制备试剂盒已使用了哺乳动物细胞系(HeLa、A549、HEK293、CHO)、新鲜/冷冻组织(脑、心脏、肝)、人血浆和血清、细菌(大肠杆菌)、酵母和 FFPE 切片进行检测。
问:我能使用不同的裂解缓冲液完成 EasyPep 工作流程吗?
答:EasyPep 裂解缓冲液经过优化,以便与 EasyPep MS 样本制备试剂盒中使用的顺序化学方法、消化和纯化配合使用。不建议使用其他裂解缓冲液,因为它们可能含有会干扰还原、烷基化、消化或多肽纯化的缓冲液或洗涤剂。
问:我如何才能测量多肽得率?
答:可使用 Pierce 定量肽测定试剂盒(货号23275)或 Pierce 定量荧光肽测定试剂盒(货号23290)测量多肽得率。
问:我是否应该使用蛋白 A/G 或链霉亲和素微珠进行亲和纯化?
答:两种方法都可提供可靠的免疫沉淀结果。含链霉亲和素微珠的生物素标记抗体的荧光背景较低,但需要较多的前期样本制备。蛋白 A/G 微珠可靠且使用简单,但是比链霉亲和素微珠的荧光背景高。
问:我应该在哪一步骤使用 TMT 试剂标记样本?
答:如果样本在不含伯胺的合适缓冲液(如 Tris、甘氨酸)中在合适的 pH (8-8.5) 下缓冲,则可在还原、烷基化和消化后与纯化前进行 TMT 标记。TMT 标记也可在多肽纯化后进行。在纯化后标记多肽可实现多肽样本的测量和标准化,以便均匀混合。
问:我如何测量样本的消化效率?
答:可通过评估样本中缺失的切割多肽的数量来测量消化效率。用于质谱分析的 Pierce 消化指示剂也可以添加到样本中,以监测消化效率。
问:我如何才能提高蛋白样本的消化效率?
答:可通过添加更多酶、孵育更长酶切时间以及确保消化所用 pH 值是正确的来提高消化效率。为确保大多数蛋白酶具有极高消化效率,建议避免使用蛋白酶抑制剂和强效变性剂。
问:我希望尽量减少缺失的切割多肽的数量,以实现极佳消化。我应该选择哪种酶:仅胰蛋白酶、LysC 后用胰蛋白酶还是胰蛋白酶与 LysC 的混合物?
答:胰蛋白酶在赖氨酸和精氨酸处切割,但如果这些氨基酸后有脯氨酸,则很难完全消化多肽序列。LysC 仅在赖氨酸处切割,可以切割赖氨酸后有脯氨酸的序列。因此,通常将 LysC 与胰蛋白酶一起使用,以减少缺失的切割数。采用 LysC 后用胰蛋白酶进行顺序消化是尽量减少缺失的切割多肽的数量之最佳方法,因为每个酶均可在其最佳状态下使用。但是,胰蛋白酶与 LysC 混合物也可用于在更短的孵育时间(<3 小时)下同时消化样本。
问:我可以使用什么软件进行蛋白质组学数据分析?
答:我们建议使用 Proteome Discoverer 进行蛋白质组学数据分析。
问:在哪里可以找到 SureQuant 试剂盒和工作流程的资源?
答:SureQuant 靶向质谱分析测定试剂盒手册可在 Thermo 网站上取得。有关下载附件和其他文件的说明,请访问 thermofisher.com/surequantdocs 并输入试剂盒标签上标示的代码,以查看仪器方法和数据分析信息。SureQuant 工作流程解决方案可在 www.thermofisher.com/surequant 上取得。
问:哪些样本制备方法可用于血液中的低丰度蛋白?
答:High-Select Top14 高丰度蛋白去除微型离心柱(货号 A36369)可用于去除前14名的高丰度血浆/血清蛋白。可以使用 EasyPep MS 样本制备试剂盒处理去除的样本以生成消化的血浆/血清样本。可通过 nanoLC-MS/MS 分析(对于发现型试验)或 nanoLC-PRM/MS 分析(靶标型试验)处理干净的消化样本。
问:是否有适用于膜蛋白的质谱试剂?
答:CHAPS (货号28299)、OTG (货号28351)和脱氧胆酸钠 (货号89904)是通常用于溶解和提取样本中的膜蛋白的洗涤剂。
问:如何使用 EasyPep MS 样本制备试剂盒(货号 A40006)处理细菌样本?
答:将 1-2uL 的 50mg/ml 溶菌酶溶液(货号90082)加入试剂盒中附带的 200uL EasyPep 裂解缓冲液中,然后继续进行样本制备。加入 200ul 裂解溶液 5 X 10^ 8 细菌细胞大肠杆菌细胞。(OD600 等于1,对应于 1 X 10^8 CFU)。重复移液样本以裂解并在 16,000xg 下离心5分钟。或者,可通过珠磨或超声处理代替溶菌酶在裂解缓冲液中裂解大肠杆菌细胞。在裂解后,使用裂解缓冲液将样本稀释至 1mg/ml,然后继续执行 EasyPep 实验方案以按照产品手册中的说明进行还原、烷基化、消化和纯化。
问:如何使用 EasyPep 处理酵母样本?
答:向 EasyPep 样本制备试剂盒(货号 A40006)中附带的 EasyPep 裂解缓冲液中的颗粒样本中加入直径为 0.5mm 的玻璃微珠并按照 EasyPep 实验方案中的建议继续操作。剧烈旋晃数分钟,在 16,000xg 下离心5分钟并提取上清液以进行蛋白测定和进一步下游样本制备。
问:我如何处理福尔马林固定石蜡包埋 (FFPE) 样本以进行 MS 分析?
答:必须先使用二甲苯去除 FFPE 切片并依次使用 EtOH(100 %、95 %、80%)洗涤以便为组织补水。使用手动均质或超声处理以提取蛋白,然后,在 95°C 下加热2小时以反转蛋白交联。
问:什么方法适用于抗体还原、烷基化和消化?
答:在 7.0 M 盐酸胍、100 mM Tris(pH 值为8.3)中制备 1mg/ml 抗体。欲进行还原,加入最终浓度为 10mM 的 DTT(货号 A39255)溶液并在室温下孵育30分钟。欲进行烷基化,加入最终浓度为 20mM 的碘乙酸钠并在室温下避光孵育20分钟。进行缓冲液交换,然后使用 Pierce MS 级胰蛋白酶(货号90058)(酶与底物比为 1:10)进行消化。
问:我想在消化前还原样本。当使用碘乙酰胺进行烷基化时,我应该使用 DTT 还是 TCEP 还原蛋白?
答:DTT 和 TCEP 都可以用于还原二硫键,这有助于变性蛋白以改善酶消化。通常,使用 5-10 mM 的还原剂进行蛋白还原。加热样本 (>37°C) 可助于加快还原反应。对于大多数应用,建议使用额外的 3-5 摩尔 (10-30mM) 的碘乙酰胺。如果 DTT 用作还原剂,在烷基化后,可以添加额外的 DTT 以淬灭多余的碘乙酰胺。使用 TCEP 时,无需此淬灭步骤。最后,应在 pH 值为 7-9 时进行还原和烷基化反应,因此,建议使用缓冲的 TCEP 溶液(如 Bond Breaker TCEP 溶液)而不是 TCEP-HCl 进行还原。
问:哪种酶最适合用于蛋白消化?
答:胰蛋白酶 (货号90058)或胰蛋白酶/LysC (货号 A41007)混合物最常用于蛋白质组学应用,确保重现性和完全消化。其他用于纯化蛋白表征和特殊应用的常用酶包括胰凝乳蛋白酶 (货号90056)、胃蛋白酶 (货号 20343)、LysN (货号 90300)、AspN (货号 90053)、GluC (货号:90054)。
问:当我使用 Pierce 定量比色肽测定试剂盒(货号23275)定量我的多肽样本时,我获得的结果与使用 Pierce 定量荧光肽测定试剂盒(货号23290)时得到的结果不同。哪种试剂盒最适合用于较准确地定量?
答:由于不同的肽测定试剂盒使用不同的化学成分来测定多肽,产生的结果可能不尽相同。干扰化合物是最常见的背景和不准确测量来源。不推荐将荧光肽测定试剂盒用于使用 TMT 试剂修饰的多肽。
问:细胞裂解后,我的样本非常粘稠并且难以移液。我如何才能降低样本粘度?
答:裂解后样本粘度高是由于细胞核释放了 DNA。超声处理或添加核酸酶(如 Pierce 通用核酸酶(货号88700))可用于分解 DNA 并降低样本粘度。
问:我想富集我的磷酸肽样本。我应使用 High-Select TiO2 磷酸肽富集试剂盒(货号 A32993)、High-Select Fe-NTA 磷酸肽富集试剂盒(货号 A32992),还是两种都使用?
答:每个试剂盒对不同磷酸肽的选择性不同。High-Select TiO2 磷酸肽富集试剂盒可富集更多的磷酸化多肽。High-Select Fe-NTA 磷酸肽富集试剂盒富集的單磷酸化肽较多。此外,High-Select Fe-NTA 磷酸肽富集试剂盒的磷酸肽特异性和得率稍高于 TiO2 试剂盒。为了最佳地富集所有类型的磷酸化肽,我们建议使用我们的 SMOAC 方法,该方法依次利用两种试剂盒。
问:当我使用 SMOAC 方法时,在干燥后,TiO2 富集的洗涤/流出样本中残留一小颗非挥发性物质。这是否正常?
答:这是正常的,用于 TiO2 柱结合的缓冲液含有一种非挥发性酸,干燥后,它会在样本管中显现。残余材料不会干扰后续的 Fe-NTA 富集并在 LC-MS 分析前被去除。
问:我想对复杂样本进行组分分离,但我的样本与 Pierce 高 pH 反相肽组分分离试剂盒(货号84868)的说明书中描述的样品不同我是否应使用自定义的组分分离梯度?
答:推荐的梯度适用于带或不带 TMT 标记的蛋白消化样本。使用其他化学标记、执行选择性肽富集或者使用不是胰蛋白酶的其他消化酶可能会影响组分分离过程中肽的洗脱曲线。为使样本肽覆盖度最佳,理想的洗脱曲线是每个组分内肽数量相对相同。
问:我只有 200ug 的蛋白消化样本。这是否足以进行 Fe-NTA 富集?
答:我们建议至少使用 0.5mg-3mg 干净的(即 C18 脱盐的)干燥蛋白消化物以获得最佳结果,预期得率为 1-3%。使用较少量的蛋白消化样本是可行的;但是,磷酸肽得率明显较低,在富集后,可能存在较多非磷酸肽,必须额外注意以防损失剩余的少量样本。
问:在磷酸肽富集前,是否需要进行 C18 纯化?
答:是的!C18 对于去除可能干扰磷酸肽富集的小分子十分必要。还需要在纯化后干燥以浓缩稀释样本并去除 C18 有机洗脱溶剂,以便样本可以在优化的缓冲液中溶解以进行磷酸肽结合。不推荐使用其他结合缓冲液,因为磷酸肽得率和特异性会受到影响。为了实现最高性能,请通过搅拌至少10分钟确保将干净的干燥肽样本完全溶解在结合缓冲液中。
问:使用 Pierce 高 pH 反相组分分离试剂盒进行样本组分分离需要多少起始材料?
答:推荐使用至少 100ug 的蛋白消化物进行八组分的组分离。如果使用的组分较少,则可使用较少的样本。
问:使用 High-Select Fe-NTA 磷酸肽富集试剂盒进行磷酸肽富集后,我注意到我的洗脱液中或干燥样本后出现黄色/浅褐色物质。这是否正常?
答:黄色/浅褐色指示存在铁,即已经在洗脱期间从柱上随着磷酸肽释放出铁。在 0.1% 甲酸中酸化洗脱缓冲液或重悬干燥肽后,可以通过在 16,000xg 下离心旋转30秒并将上清液转移到新容器中进行 LC/MS 进样或肽定量以去除此物质。或者,也可以使用肽脱盐柱或 C18 吸头来去除此物质。
问:我使用 High-Select TiO2 磷酸肽富集试剂盒(货号 A32993)或 High-Select Fe-NTA 磷酸肽富集试剂盒(货号 A329929)时富集磷酸肽的特异性较差。我应该怎么办?
答:检查有效期以确保所有成分仍然是可作用的。在保存期间,应使 TiO2 吸头避免受光。请确保您使用正确的缓冲液成分重悬样本且样本完全干燥、重悬。使用 Fe-NTA 试剂盒孵育肽样本时,确保您避免端对端旋转或旋晃;而是轻轻叩击柱以使树脂散开。从柱上拆下插塞时,确保不要将液体从塞槽推回柱内。洗脱后,切勿将磷酸肽储存在洗脱缓冲液中,立即干燥样本,然后,在 -80°C 下储存,直到需进行质谱分析。
问:我如何在 High-Select HSA/免疫球蛋白去除树脂和 High Select Top14 高丰度蛋白去除树脂中进行选择?
答:大多数客户使用 Top14 树脂去除丰度较高的蛋白。使用前2种产品的客户可能会对此产品感兴趣,它会去除白蛋白和 IgG,这可能足以鉴别血浆中丰度较低的感兴趣的特定蛋白。
问:High Select Top 14 高丰度蛋白去除树脂去除哪些蛋白?
答:High Select Top14 高丰度蛋白去除树脂使用固定化抗体去除血清、血浆或脊髓液中的人血清白蛋白 (HSA)、白蛋白、IgG、IgA、IgM、IgD、IgE、κ 和 λ 轻链、α-1-酸性糖蛋白、α-1-抗胰蛋白酶、α-2-巨球蛋白、载脂蛋白 A1、纤维蛋白、结合珠蛋白和转铁蛋白。
问:我要制备大量血浆样本以进行 MS 分析。有没有在96孔板中去除蛋白的方法?
答:散装 Top14 去除树脂可与96孔过滤板兼容,如 Agilent 过滤微孔板(货号200957-100)。向96孔过滤板中的每个微孔中加入 600µL 树脂浆液 (50%),加入 10-20µL 的样本,轻轻摇动以进行孵育。去除的样本可在新的96孔聚丙烯板中在 100xg 下离心2分钟或使用真空歧管收集。
问:如何评估血浆高丰度蛋白去除效率和可重现性?
答:ELISA 和 MS 分析通常用于评估去除性能。去除后的蛋白得率水平可通过 BCA 测定试剂盒测定。
问:使用高丰度蛋白去除柱去除的白蛋白百分比是多少?
答:当在色谱柱上使用的是推荐的样本与树脂比时,可去除超过 99% 的白蛋白。
问:High Select 去除柱的最大上样量是多少?
答:迷你柱可以去除多达 10uL (600ug) 的血浆或血清;中等柱可以去除高达 100uL (6000ug) 的血浆或血清
问:我可以使用 High-Select HSA/免疫球蛋白去除树脂处理小鼠样本吗?
答:不可以。去除树脂含有仅鉴别人血浆蛋白的固定化抗体。
问:可以重复使用 High Select HSA/免疫球蛋白去除树脂吗?
答:我们不建议重新使用去除树脂,因为再生后的去除效率可能会降低,而后续去除的样本可能会受到先前去除的样本的污染。
问:在去除高丰度血浆蛋白后,我如何继续进行下游质谱分析样本制备?
答:在去除后,样本在缓冲液中被大幅稀释。去除的样本应通过 SpeedVac 干燥、溶剂沉淀或渗滤方式浓缩。在使用裂解缓冲液重悬后,使用 SpeedVac 干燥的样本与 EasyPep 试剂盒化学成分直接兼容。
问:在去除后,我仍然在 LC-MS 分析后看到白蛋白和其他高丰度蛋白。去除是否起效?
答:去除并不会移除样本中的所有高丰度蛋白。即使对特定血浆蛋白的去除率为 99%,高丰度蛋白仍然是 MS 分析检测到的样本中的丰度最高的蛋白。然而,去除功能可显著减少丰度最高的血浆蛋白,从而能够鉴别丰度较低的蛋白。
问:如何确定交联剂是否可渗透细胞?
答:高 logP 的疏水性交联剂的细胞膜渗透性比亲水性交联剂高。此外,具有带电官能团的交联剂(例如 sulfo-NHS)通常不具有细胞渗透性。胞浆或细胞核标记蛋白的交联可用于评估交联剂的细胞渗透性。
问:建议使用哪些溶剂进行交联剂复溶?
答:DMSO (货号85190)是建议用于大多数交联剂的溶剂。磺化交联剂可以使用 DMSO 或水复溶。
问:我如何从蛋白样本中去除过量的交联剂?
答:使用蛋白浓缩管 (货号88514)透滤或透析是去除过量交联剂的常用方法。
问:具有长 PEG 连接子的交联剂有哪些优势?
答:PEG 连接子可提高交联剂的溶解性和交联的蛋白复合物的溶解性。然而,这些交联剂可能不能渗透细胞膜,并可能干扰蛋白水解消化。具有长 PEG 间隔基的胺反应交联剂包括 BS(PEG)5(货号21581)和 BS(PEG)9(货号21582),但具有替代反应性的交联剂也可具有长 PEG 间隔基。
问:有没有交联剂可用于非赖氨酸交联?
答:我们有各样的交联剂可与多种不同的氨基酸官能团反应,包括胺、巯基、羧基、羰基和非特异性(即光反应)交联剂。请点击此处查看更多信息。
问:DSBU (货号 A35459)和 DSSO(货号 A33545)均是 MS 可切割交联剂。我应该选择哪一个?
答:尽管两种交联剂的溶解性和反应性相似,但是 DSBU 的连接子比 DSSO 长,可能导致不同的交联,具体取决于感兴趣的蛋白。此外,每种交联剂的推荐碰撞能量也不同,因为 DSBU 需要较低碎裂能量即可切割。因此,我们建议将 DSSO 用于 MS2-MS3 方法,将 DSBU 用于 MS2 方法。
问:不同的交联剂有不同的长度。我应该选择哪一个?
答:交联剂的长度决定了哪些交联可行并为蛋白结构测定提供了距离限制。有些交联的结构刚性小于其他交联,导致可能出现多种不一样的交联。应根据反应氨基酸的可用性及其在感兴趣的蛋白结构中的位置来选择交联剂长度。多种交联剂可能提供互补信息并更好地解析蛋白结构。
问:如何将单联(死端交联修饰的肽)与交联分开?
答:组分分离技术是分开交联和单联的最常见方法;强阳离子交换和体积排阻色谱分析通常是成功的。
问:我该如何确认我的蛋白样本是否交联?
答:在感兴趣的蛋白上是否交联通常使用 SDS-PAGE 来确认。与未修饰的对照样本相比,交联后,交联蛋白分子量应较大,这表现在降低的凝胶迁移率。
问:大多数交联剂为同型双功能交联剂,在两端具有相同反应性。 选择异型双功能交联剂的原因是什么?
答:异型双功能交联剂具有不同的反应基团以进行蛋白偶联和交联。 与同型双功能交联剂相比,不同的反应基团可产生不同的交联。此外,部分异型双功能交联剂采用可活化的化学成分,能显著提高蛋白之间的偶联概率并尽量减少蛋白内交联。
问:添加交联剂后,我观察不到任何交联蛋白。出现了什么问题?
答:确保用于交联的缓冲液与交联剂兼容且是在建议的 pH 值以达较佳反应性。滴定交联剂以确定试剂与蛋白的最佳超额摩尔。避免使用含胺缓冲液进行基于 NHS 的交联反应。根据蛋白不同,您可能需要尝试不同长度或反应性的交联剂才能成功。
问:我发现我的蛋白通过 SDS-PAGE 交联,但在 MS 分析中未发现很多交联。您建议如何改善我的结果?
答:首先,验证是否为数据库搜索软件选择了正确的交联剂和修饰。此外,检查您的 MS 采集方法的交联剂质量是否适合 MS1 选择和 MS/MS 片段化。最后,尝试使用不同的交联剂或 MS 可切割的交联剂以增加已鉴别的交联肽的数量。
问:我发现交联肽超出了交联剂长度的距离限制。这怎么可能?
答:如果蛋白是二聚体或多聚体复合物的一部分,则可能在相同蛋白的肽之间发生交联,这些交联是蛋白内的交联,可能超出距离限制。或者,在交联反应之前或期间,蛋白可能已变性,这可能导致氨基酸之间的交联,这比天然蛋白结构上发现的交联相隔更远。
相关资源
仅供科研使用,不可用于诊断目的。